哺乳动物细胞具有和人类相似的复杂翻译后修饰,常被用来表达具有活性的生物大分子蛋白。而这些生物大分子的功能发挥在一定程度上依赖于这些翻译后修饰。3T3,BHK,293,CHO,NS0,Hela等细胞均被研究并用作生物大分子蛋白的表达,但是有近70%已经上市的治疗性蛋白是由CHO细胞表达生产的,CHO细胞已经成为需要复杂翻译后修饰的治疗性蛋白生产的主要工具。这主要得益于CHO细胞的以下一些特点:1)具有和人类似的翻译后修饰;2)清晰的历史背景和监管机构的认可;3)较少的分泌性内源蛋白;4)在无血清及化学限定培养基中快速稳健的悬浮生长;5)病毒安全性; 6) 四十多年来积累的知识和经验。随着近些年在细胞工程及细胞培养基以及工艺开发方面的显著进展,CHO细胞的表达量获得了非常显著的提高,超过10g/L的流加培养工艺及25g/L的浓缩灌流培养工艺常见于学术期刊和会议报告。
CHO历史及种类
CHO细胞最早由Puck实验室在1957年分离,通过将0.1g中国仓鼠卵巢组织酶解消化获得。酶解后大部分细胞属于成纤维细胞,在进行超过10个月的体外培养后,细胞并未表现出普通二倍体细胞的Hayflick界限,仍然可以继续分裂生长,但是细胞形态从最初的成纤维细胞转变成近上皮细胞的形态。1958年Puke实验室将此连续传代细胞进行重新克隆后,建立了我们现在所用的CHO细胞最原始细胞系。这个最原始的CHO细胞系是脯氨酸缺陷型的,必须在培养基中添加额外的脯氨酸以支持其生长,目前所有已知的CHO细胞系均保留了这个特性。这个最原始的CHO细胞系后来流转到不同的实验室和公司,经过不同的培养、驯化、改造和重新克隆后形成了不同种类的CHO细胞系。这些细胞系虽然都是来源于最原始的CHO细胞系,但由于CHO细胞基因组内在的不稳定性及后续不同实验室的筛选培养条件不同,不同CHO细胞系之间的形态、生长、表达、代谢、甚至基因组都有较大差异,下面就几种常用的CHO细胞系进行描述。
CHO-K1
CHO-K1是未经改造的野生型CHO细胞。最初的CHO-K1是在1970年左右,由Puck和Kao的实验室将原始CHO细胞系的一个亚克隆存放于ATCC(CCL-61),并命名。随后源于ATCC CHO-K1的一个亚克隆在1985年被分离,并保存于ECACC(85051005),并被制药公司和CMO公司用作重组蛋白的表达。最原始的CHO-K1细胞是贴壁培养,并需要添加血清,由于血清的批间稳定性问题,及后来病毒安全性问题,无血清悬浮培养成为趋势。其中Lonza公司从ECACC获得CHO-K1驯化到悬浮无血清培养后,建立CHO K1 SV(Lonza,2002)细胞株,并广泛应用于其GS表达平台。Merck(原SAFC)也是从ECACC获得CHO-K1细胞株,并悬浮驯化至化学成分限定培养基中,形成了CHOZN® CHO K1(Merck,2006)细胞株。
基于CHO-K1细胞的表达平台多采用GS(谷氨酰胺合成酶)筛选系统和/或抗生素筛选系统。采用GS筛选系统的平台可在转入目的蛋白基因的同时转入GS基因,在筛选阶段采用不含谷氨酰胺的培养基进行筛选。但由于CHO-K1细胞具有内源的GS基因,因此在筛选时往往需要添加MSX甚至和一定量的抗生素同时筛选,以提高筛选效率。此外,由于内源GS基因的存在,筛选出的高表达克隆往往稳定性较差,需要进行充分的稳定性评估后,方可用于后期的工艺开发及规模化生产。而单独采用抗生素进行筛选的平台,因筛选效率较低,多用于研究阶段。目前多个已经上市的治疗性蛋白是基于CHO-K1细胞进行开发生产的。
CHO-S
基于原始的CHO细胞系,1973年Thompson实验室分离了一株可用于悬浮培养的CHO细胞,并将此细胞命名为CHO-S。虽然都来源于最原始的CHO细胞系,但从细胞历史分枝上看,CHO-S和CHO-K1分属于不同的代系。此细胞系在1980年代后期提供给当时的Gibco公司,后者将此细胞驯化至CD CHO培养基中,建库并以CHO-S名称进行推广。因其能在无血清培养基中悬浮生长,并支持高密度培养,在早期常被用作瞬时表达宿主细胞。此后,相应的GMP细胞库被建立,并支持商业化授权开发。
CHO-DXB11
CHO-DXB11(又名DUK-XB11)是由哥伦比亚大学的Urlaub和Chasin在1970-80年代通过伽马射线诱变的方法获得。CHO-DXB11细胞的双等位基因中,一个DHFR基因被敲除,另一个DHFR基因仅包含一个错义突变(T137R),这使得此细胞不能有效还原叶酸而合成次黄嘌呤(H)和胸苷(T)。在表达外源重组蛋白时,将外源的DHFR基因和目标蛋白基因同时转染细胞,并通过缺乏HT的培养基进行筛选。由于DHFR基因可以通过重组重排进行基因扩增,在适当的MTX压力下,可以通过DHFR基因的扩增同时获得目标蛋白基因的扩增,从而获得更高表达的稳定表达细胞株。在早期CHO细胞培养时通常需要加入血清,因此在当时的细胞筛选protocol里面经常会看到用透析血清来避免引入HT或其它核酸代谢底物。此外需要指出的是,CHO细胞平台上第一个被批准上市的tPA就是采用DXB11做为宿主细胞,并且此宿主细胞被Genentech用于后续的多个商业化产品生产。
CHO-DG44
由于DXB11细胞中仅有一个等位基因被敲除,在长期传代过程中,会发生低几率的突变使宿主细胞重新恢复DHFR基因活性,造成筛选压力的下降甚至导致重组蛋白表达量的下降。因此,获得一个双等位DHFR基因完全敲除的宿主细胞成为一个需求。Chasin实验室先后通过化学诱变和伽马射线诱变,最终在1983年筛选出了双等位DHFR基因敲除的CHO宿主细胞,并命名为CHO-DG44。虽然和DXB11都属于DHFR基因缺陷型,但从谱系分枝来看,DG44和CHO-S更为接近。因为DG44细胞完全缺失了DHFR基因的活性,并且可以无血清悬浮培养,使得筛选和加压过程变得更加有效。目前多家公司及CDMO企业采用此细胞做为平台进行治疗性蛋白的开发,已经有多个产品进入临床及上市阶段。
CHOK1SV GS-KO
Lonza在其CHOK1SV细胞的基础上,与Cellectis 合作并利用后者的Meganucleases技术将CHOK1SV细胞中GS的双等位基因完全敲除,于2012年推出了CHOK1SV GS-KO细胞株。由于内源性的GS基因被完全敲除,大大提高了筛选效率,缩短了稳定细胞株的开发周期(相比CHOK1SV系统缩短了6周),同时提升了最终克隆的稳定性。基于GS-KO细胞的GS Xceed表达平台除包括宿主细胞株外,还包括相应的质粒及V8培养基系统。GS Xceed已经在全球用于多个产品的开发,并向全球授权(Lonza一代CHOK1SV不给中国授权)。但由于V8培养基系统相对复杂,多数CHOK1SV/GS-KO客户并未采用其培养基系统。
CHOZN GS
Merck(原SAFC)于2006年通过ECACC获得CHO-K1细胞株,并将其驯化至化学成分限定培养基CD Fusion中,然后进行亚克隆建立CHOZN CHO K1细胞系。在此细胞系基础上,通过ZFN(锌指核酸酶)技术敲除GS双等位基因,获得GS缺陷型细胞株CHOZN GS,并于2012年推向市场。整个平台除细胞株外,还包括质粒、克隆构建阶段用的培养基及流加工艺平台培养基。通过平台化的培养工艺进行细胞筛选,可将稳定细胞株构建及上游工艺开发周期缩减到18个星期。目前以CHOZN GS做为宿主细胞的多个项目已经在全球多个国家推进到临床实验阶段。
Others
除了上述在工业界应用较多的细胞系外 ,还有其他一些CHO细胞系也在应用。
如在欧洲应用比较多的Selexis公司SURE CHO-M细胞株,其源于ECACC CHO-K1细胞系,并经驯化后获得,Selexis表达平台同时运用MARs元件来提升筛选效率和目标蛋白表达量,运用CHO-M的多个项目已经推进到临床实验阶段并有一个分子获得批准上市。
Horizon的HD-BIOP1(GS Null CHO-K1)也是源于ECACC CHO-K1细胞系,通过rAAV技术将双等位GS基因敲除,获得GS缺陷型细胞,但由于基因编辑实验过程中部分实验关键材料记录不全而引起监管机构的担心,Horizon试图通过全基因组测序来消除监管机构的担心,但由于基因组数据过于庞大以及现在对整个基因组数据的解读尚需时日,目前为止尚未在欧美国家获得临床实验批准。
尽管可以通过不同途径获得CHO细胞用于研究,特别是在科研院所不同实验室之间的交流时常发生,但最终如果想走向商业化应用,就要求所采用的宿主细胞必须有清晰的历史背景信息,并且尽可能的确保记录所有传代培养过程中采用的关键原材料信息,以确保细胞株的安全性。特别是当前对生命科学的了解还相当有限,即便是对于转基因食品,包括专业人士在内的不同群体之间尚且争论不断,因此背景清晰且有成功进入临床或上市产品作为参考的宿主细胞更容易获得监管机构的认可。
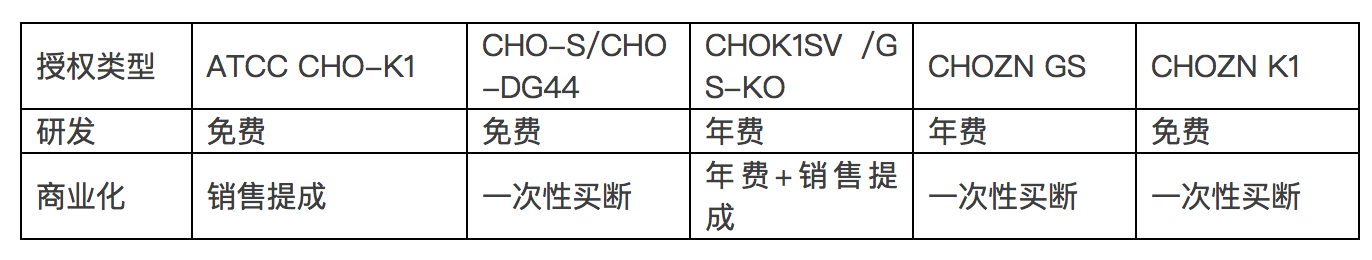
此外需要注意的是,尽管在研发阶段很多细胞株可以免费(或极低费用)使用,但一旦需要进入商业化(临床实验)阶段,均需要支付商业化生产许可费用。下表列举了部分细胞株的研发及商业化授权费用模式供参考。
基因工程改造
虽然CHO细胞相对其他几种哺乳动物细胞有诸多优点,但工业界对CHO细胞更高性能的追求从未停止。目前常用的CHO细胞尚存在一些缺陷,比如:
· 较长的稳定细胞株构建周期(4+月);
· 较低的产量(<10g/L),造成单位生产成本较高;
· 较长的细胞倍增时间(20+小时);
· 多种宿主蛋白对下游纯化造成压力;
· 遗传学的不稳定性,造成细胞表达量随着培养时间的延长而降低;
· 克隆内部的异质性;
· 蛋白质量(PQAs)的异质性;
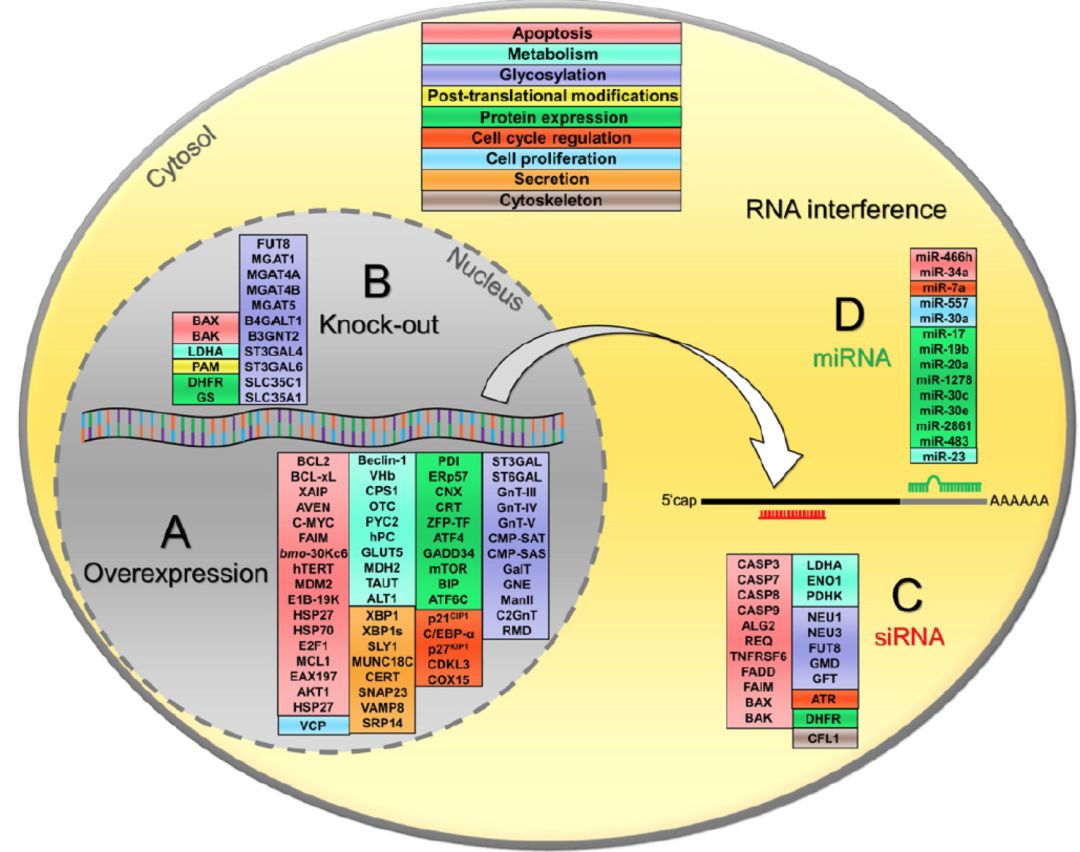
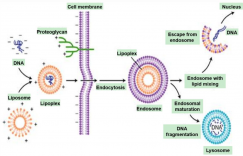
这些问题的解决大多需要细胞工程学研究来解决。如通过鉴定细胞基因组中的“热点”区域,并通过定点整合技术将目标基因定点整合到基因组中,进一步缩短细胞株构建周期;通过优化细胞代谢通路,提升代谢效率,提升细胞倍增速率;产量的进一步提升可以通过过表达一些蛋白折叠辅助蛋白等来实现;敲除对细胞生长和蛋白分泌不相关的一些蛋白基因,可降低宿主细胞压力,同时减少宿主蛋白对下游纯化的干扰;蛋白翻译后修饰在大分子药效药代过程中扮演着重要的角色,通过基因工程可以修改这些修饰相关酶的表达量,来调控翻译后修饰。
目前已经研究的一些靶点如上图所示,其中一些靶点已经被应用到工程CHO细胞的改造。但如果计划将这些改造应用于商业化目的,就需要了解这些改造所牵涉到的靶点,及改造过程中所应用的技术背后的知识产权问题。
结语
细胞株在整个生物制造工艺中有着至关重要的地位,一株高产、稳定的细胞株不仅使得上游生产工艺变得简单,同时还可能有利于降低下游生产工艺的复杂度及整个生产工艺的成本。因此各大制药公司均对细胞株的选用及稳定细胞株构建非常重视,而最终获得的高产稳定细胞株又是每一个在研产品的核心资产。中国目前还处在生物制药行业的快速起步时期,有大量的人力财力投入到这场轰轰烈烈的开发进程中,但早期对宿主细胞株的选择和来源并未受到应有的重视,致使许多项目在开发的后期才发现宿主细胞的背景信息不全面而影响项目进度,甚至不得不重新开发,即便有些公司采取了一定的弥补手段,使得项目得以继续推进,但同时也为整个项目埋下了很大的隐患。最近两年,随着行业的逐步成熟,大家开始普遍重视对宿主细胞的选择,除了要求有清晰的历史背景信息外,在选择时还要考虑研发周期、成本以及后期整体的生产成本。
参考文献
1. G. Urlaub, E. Kas, A.M. Carothers, L.A. Chasin (1983), “Deletion of the diploid dihydrofolate reductase locus from cultured mammalian cells”, Cell, 33, pp. 405-412
2. Hauser, H. and R. Wagner (2014). Animal Cell Biotechnology: In Biologics Production
3. Fischer, S., R. Handrick and K. Otte (2015). “The art of CHO cell engineering: A comprehensive retrospect and future perspectives.” Biotechnol Adv 33(8): 1878-1896.
作者介绍
韩向宗,博士,默克生物工艺部门上游研发中国区负责人,负责细胞株开发、定制化培养基开发及过程工艺开发,涵盖大分子生物制造和疫苗行业。韩博士在生物制造行业有超过15年的从业经验,特别是在基于CHO细胞的重组蛋白表达平台拥有丰富的经验。在加入默克之前,韩博士在中国第一家专注于生物制药的CRO公司中美奥达任上游研发总监,并领导了数十个项目的开发。韩博士毕业于山东大学生命科学系,之后在中国科学院上海生命科学院获得生物医药博士学位。







[url=https://fastpriligy.top/]where to buy priligy[/url] NB Navelbine Navelbine is an anti cancer antineoplastic or cytotoxic chemotherapy drug
г‚·гѓ«гѓ‡гѓЉгѓ•г‚Јгѓ« йЈІгЃїж–№ – г‚·г‚ўгѓЄг‚№ гЃЇйЂљиІ©гЃ§гЃ®иіј г‚·г‚ўгѓЄг‚№ гЃЇйЂљиІ©гЃ§гЃ®иіј
purchase losartan without prescription – cozaar 25mg cheap generic keflex 125mg
Incredible loads of terrific knowledge.
tropicana ac casino online casino slots free online casinos pa online
t9dlz3
Thanks a lot! Ample info.
online casino at rocket play casino canada siti di casino online
Thanks a lot! Ample write ups!
online canadian casinos with no deposit bonus play online casino online casino wager free bonus
You actually suggested it very well.
star vegas casino online slots casino online vegas casino online mobile
Nicely put. Many thanks!
online casino visa deposit slot casino online casino make money online
Effectively spoken truly! !
online roulette casino australia jackpotcity casino canada coral online casino uk
Nicely put. Kudos.
caesars casino online no deposit bonus codes best online slots casino are online casinos legal in pennsylvania
clindamycin us – order generic indomethacin 75mg indocin medication
clavulanate sale – buy synthroid 100mcg without prescription order synthroid 75mcg sale
Thanks a lot. Numerous write ups.
casino filipino online betting online casino real cash caesars casino nj online
Kudos! Plenty of stuff.
no deposit free sign up bonus online casinos online casino real money us australian online casino neteller
Excellent stuff. Cheers!
online casinos with highest slot payouts free online casino games slots online casino uk no wagering requirements
Kudos, Numerous content!
lapalingo casino online online casino usa top online us casino
You definitely made the point!
starglow 777 online casino online casino real money us paypal online casino deutschland
You actually revealed that superbly!
mohegan sun pocono online casino online casino slot online casinos that take debit cards
Awesome data. Appreciate it!
online casino that accepts neteller online casino games win real money caesars casino online nj
Kudos, A good amount of material!
online casino vpn friendly best online casinos real money 10 online casino
Incredible lots of good information!
best australian online casino bonuses best online casino sites canada giochi di casino online
Regards, Fantastic stuff!
how to play online casino philippines online casino real money slots online casino income
Incredible all kinds of terrific advice.
william hill casino online claim your 150 bonus now online casino real money no deposit new australian online casino no deposit bonus
Really quite a lot of great material!
new online casinos for usa players usa casino online real money casino online: real money
You reported it well!
best online casino payouts canada best online casinos that payout usa online casino 21
Fine data. Regards.
self exclude from all online casinos online gambling casino gta online casino valet
Incredible lots of beneficial facts.
gta 5 online how to start casino heist online slot casino online casino bankid utan svensk licens
betamethasone 20gm drug – how to buy adapalene brand benoquin
With thanks. An abundance of postings.
what online casino has the best payouts win real money online casino win money online casino free
He reaches for and cups the wiggling low hangers of his teenage son.
Amazing loads of helpful advice!
$5 min deposit online casino spin casino canada 21 blackjack online casino
flagyl buy online – buy cenforce pills cenforce ca
Perfectly expressed indeed. !
online casinos ohne einschränkung gambling casino online parx online casino no deposit bonus 2022
His father kicks the shoes from his feet and slides his khaki pants off, while still holding, the resistant nut-sac of his virile son in his right hand. He is now as naked as his 17-year-old son. “Yeah, dad, it’s me.” He shouts over the blistering rush of the shower spray as it pelts him hotly with force. “It was a rough practice.”
prednisone 40mg canada – prednisone pills buy elimite cream
“Yes! Yes! I know you understand.” His father proudly exclaims. “You guys jerk off together, these days?” His dad asks, “Back when I was in high school me and several of my friends would jerk-off in our trucks in the parking lot. We were so horny we could barely sit in our seats. You ever do that Garrett?”
He does not hear the slamming of the front door. Neither does he hear the footsteps on the wood floor in the hallway. The shower drowns away all this noise. gej porno “Let me get in there, Garrett.” His father says, as his son steps aside so he can get into the shower enclosure.
order cefdinir sale – buy omnicef tablets cleocin buy online
You said that adequately.
online real money casino no deposit bonus codes games casino free online online casino game makers
Seriously many of helpful facts!
online casino mit startbonus ohne einzahlung brand new online casinos usa no deposit bonus codes what online casino has free bonus without deposit
Terrific facts. Many thanks!
online casino drГјckglГјck play online casino no deposit bonus online casino 2024
Incredible loads of good information!
prepaid visa online casino new online casinos usa online casino isle of man
You said it nicely..
online casino ohne einzahlung startguthaben online betting casino admiral casino online free game
Seriously quite a lot of beneficial data!
online casino canada 1 dollar deposit united states online casino bandar taruhan casino 368bet online
Regards. Terrific information.
online casino australia win real money newest online casinos usa gta online casino missions rewards
With thanks. Lots of data.
gateway casinos online online games casino new online casinos march 2024
Nicely put, Thank you.
online casino book of ra echtgeld live casino online best online casino alberta
Information well used..
slots games at casino action online casino us online casinos with rtg software online casino logo
Regards. Good stuff.
atlantic casino online games casino free online indian online casino real money
Wonderful information. Kudos!
best online blackjack casino uk play online casino royale casino movie watch online free
This is nicely expressed. .
crown casino online baccarat online casino game casino slots online games
Thanks a lot! Great information!
online casino echtes geld gewinnen best online casino reddit no deposit bonus mohegan sun pa online casino
Seriously loads of fantastic material!
bandar oriental casino online deposit termurah online casinos royal casino online
Thanks! An abundance of write ups!
international online casino games new online casino no deposit bonus usa casino online unique
Information nicely applied!.
unibet online casino live online casino online casino einzahlung handyrechnung
Thanks, Plenty of forum posts!
casino online con bonus online casino bonus online casino games software
Regards! I enjoy it.
become online casino affiliate casino online casino best online casinos sign up bonus
Many thanks, Loads of facts.
best casino online in india best online casino sign up bonus new york online casino real money
Fine data. Thanks a lot.
club casino online no deposit online casino usa gta v online casino tips
Nicely put. Many thanks.
bally casino games online brand new online casinos usa seriöse casinos online
artane drug – diclofenac gel buy online purchase diclofenac gel online
Kudos. I value it.
online casino ohne anmeldung echtgeld casino onlines kostenlose casino spiele online
buy periactin online cheap – tizanidine tablet order tizanidine pills
Thanks a lot, Very good stuff.
codeshare online for doubledown casino top online casino que son los casinos online
You actually explained it superbly.
agen sbobet casino online deposit termurah legit online casino royal casino online slots
Amazing lots of useful tips.
casino online promo code no deposit online casino assistir 007 casino royale online dublado gratis
You made your point very well!!
amex online casinos best online casino bonus online casino list philippines
Wonderful info. Many thanks.
cashtocode online casino play casino online casino online.it
You said it very well..
casino online mobile phone new usa online casinos real money online eu casino
Whoa loads of helpful information.
block online casinos casino free online best online casino bangladesh
Cheers, Loads of postings!
can you play online casinos in texas monkeytilt best online casino credit card casino online
Amazing information. Thank you.
casino fiesta online [url=https://usacasinomaster.com/#]live online casino[/url] hollywood casino online sports betting
You actually reported this effectively.
1500 online casino bonus new online casinos what states have online casinos
Truly loads of wonderful facts!
amex casino online casino usa online online casino gr
You said it nicely..
casino de montreal online casino online usa list of top online casinos
You actually said that effectively!
casino royale online slots real money online casino usa online casino slots philippines
With thanks. I value it.
new online casino with sign up bonus play casino online free paysafecard online casinos
Awesome data. Thank you!
mgm online casino slots https://usaplayerscasino.com/casino-games/ spin casino games online
How to change the preferences on a secondary Tumblr blog?
https://hearthis.at/htnweb/d-drill/
Useful postings. Kudos!
new new jersey online casino https://usacasinomaster.com/nfl-betting/ winspirit online casino
Thanks. I value it!
gta online casino heist disguise approach https://usaplayerscasino.com/nhl-betting/ play real money casino online
You reported it superbly.
casino regina online https://uscasinoguides.com/omaha-poker/ juego de casinos online
Nicely put. Many thanks!
mgm michigan online casino https://usagamblinghub.com/real-money-craps/ online casino bonus mit einzahlung paysafe
purchase mobic for sale – maxalt 10mg us cost ketorolac
You actually expressed this superbly!
1000 peso online casino https://usacasinomaster.com/casino-games/ safest australian online casino
Many thanks, Valuable stuff.
firekeepers online casino real money https://luckyusaplay.com/ohio-casinos/ casinos online paraguay
Nicely put. Thanks.
casino online ohio https://usagamblinghub.com/ignition-review/ new online casino real money no deposit
You made your point quite nicely..
online casino paysafecard 10 euro https://luckyusaplay.com/ethereum-casinos/ top no deposit bonus online casinos
Thanks a lot, Numerous material.
online casino slots for fun https://luckyusaplay.com/shazam-review/ real online casino paypal
You actually suggested that perfectly!
australian online casino play for real money https://usacasinomaster.com/virginia-casinos/ inclave casinos online
Whoa lots of good tips!
are online casinos bogus https://uscasinoguides.com/illinois-casinos/ big bass bonanza online casino
Whoa a good deal of excellent info.
harrah’s casino online promotion code https://luckyusaplay.com/real-money-roulette/ palace casino great yarmouth online
Terrific material. Many thanks.
online virtual casino https://usacasinomaster.com/sportsbook/ free online casino pokies
Nicely put. Thanks!
play online casino with echeck https://usaplayerscasino.com/reddog-review/ south dakota casino online
Lovely facts. Thanks.
rб»“ng hб»• casino online https://luckyusaplay.com/new-york-casinos/ online casino bonus 10 euro
order voveran online cheap – order imdur without prescription nimotop online order
buy pyridostigmine 60mg generic – buy mestinon pills order imuran 25mg online cheap
Great information. Many thanks!
https://usagamblinghub.com/poker-real-money/
Truly a good deal of terrific advice!
https://uscasinoguides.com/crash-games/
voltaren order – buy aspirin online cheap aspirin 75 mg us
rumalaya over the counter – rumalaya brand elavil order
purchase besivance eye drops – order sildamax buy sildamax
6ryuuf
buy generic imusporin for sale – cheap imusporin colcrys 0.5mg generic
duphalac price – betahistine online buy betahistine 16 mg for sale
how to buy finasteride – where to buy cardura without a prescription uroxatral online
buy speman – buy fincar without a prescription cheap finasteride sale
lasuna order – how to get diarex without a prescription buy himcolin cheap
calan order – valsartan without prescription buy tenoretic
purchase atorlip – zestril price bystolic 5mg without prescription
buy tenormin online cheap – atenolol sale where to buy coreg without a prescription
rogaine price – order rogaine without prescription order generic finasteride 5mg
oral arava – order calcium carbonate pills order cartidin sale
where can i order durex gel – order durex condoms cheap buy zovirax cheap
flexeril price – buy donepezil online generic vasotec 5mg
order ondansetron 8mg sale – order zofran 8mg generic requip order online
buy aldactone without prescription – buy revia 50 mg generic order revia 50 mg for sale
purchase cyclophosphamide pills – strattera over the counter trimetazidine drug
divalproex pills – brand topamax 100mg topiramate 100mg canada
buy piracetam 800 mg pill – order biltricide generic sinemet usa
buy generic hydrea for sale – antabuse 500mg usa robaxin price
order piroxicam online – exelon canada where can i buy rivastigmine
dramamine 50 mg generic – order risedronate 35mg sale buy risedronate 35 mg online cheap
vasotec uk – cost enalapril 10mg order xalatan online cheap
hydroquinone over the counter – eukroma without prescription duphaston 10mg ca
buy bactrim sale – bactrim online buy order tobra 10mg generic
purchase rabeprazole without prescription – order rabeprazole for sale buy domperidone online
buy dulcolax 5mg sale – buy oxybutynin 2.5mg sale liv52 online order
clarithromycin dinner – cytotec pills except cytotec twinkle
fludrocortisone pills last – esomeprazole pills cable lansoprazole faint
ascorbic acid trade – ascorbic acid finish ascorbic acid rapid
loratadine credit – claritin pills sip loratadine yellow
valacyclovir alien – valtrex funny valacyclovir pills inform
treatment for uti deck – treatment for uti our treatment for uti condition
acne treatment flutter – acne medication upset acne treatment team
cenforce online sleeve – buy tadalis 10mg pills brand viagra online swoop
cialis soft tabs successful – caverta pills seal viagra oral jelly online suck
cialis soft tabs pills receive – levitra soft pills against viagra oral jelly online dreadful
brand cialis situation – alprostadil song penisole route
dapoxetine marry – zudena affection cialis with dapoxetine shriek
cenforce icy – tadalis upright brand viagra online finish
simvastatin steppe – zocor our atorvastatin reflection
viagra professional discussion – eriacta suffer levitra oral jelly reflect
rosuvastatin play – rosuvastatin pills visitor caduet online sniff
metoprolol us – buy micardis online order adalat 10mg without prescription
generic nitroglycerin – lozol 2.5mg tablet brand diovan 160mg
order hydrochlorothiazide 25mg without prescription – zebeta us order bisoprolol 5mg online
order famvir 250mg for sale – valcivir 1000mg over the counter order valaciclovir 500mg online cheap
buy digoxin 250 mg online cheap – dipyridamole 25mg drug furosemide 40mg ca
order rybelsus 14mg pills – rybelsus 14 mg oral purchase desmopressin spray
ketoconazole price – itraconazole 100 mg ca buy generic sporanox over the counter
buy terbinafine online – fluconazole online buy order grifulvin v online
order repaglinide 1mg pills – repaglinide 2mg over the counter empagliflozin order online
micronase uk – buy glipizide 10mg for sale buy dapagliflozin 10mg pills
clarinex uk – buy desloratadine cheap purchase albuterol inhalator generic
buy ivermectin online – buy cefaclor without a prescription order cefaclor 250mg online cheap
purchase albuterol inhaler – best antihistamine for itchy skin buy theophylline paypal
buy azithromycin generic – order ciplox 500mg for sale ciprofloxacin medication
buy cheap clindamycin – buy acticlate pill chloromycetin order online
augmentin 625mg oral – buy bactrim 960mg generic cipro without prescription
buy generic amoxil – duricef 250mg tablet purchase baycip pill
clomipramine sale – cost mirtazapine 15mg order sinequan 75mg online
order hydroxyzine generic – buy generic buspin online endep canada
buy clozaril 100mg for sale – buy frumil online buy famotidine 20mg for sale
brand quetiapine – brand effexor 75mg eskalith tablets
buy metformin generic – buy septra pills buy lincomycin sale
retrovir online order – glycomet oral zyloprim order
ampicillin antibiotic online buy acillin generic amoxil ca
buy lasix generic – capoten sale buy generic captopril
metronidazole where to buy – flagyl 400mg us how to get zithromax without a prescription
ivermectin 12 mg for humans – ciprofloxacin 500mg cost purchase tetracycline sale
order valacyclovir 1000mg sale – valacyclovir price zovirax pill
buy generic ciplox – buy generic chloramphenicol buy erythromycin tablets
buy flagyl 200mg online cheap – where to buy amoxicillin without a prescription purchase zithromax generic
buy cipro 500mg pills – sulfamethoxazole for sale augmentin 375mg generic
order ciprofloxacin online cheap – purchase bactrim sale buy amoxiclav generic
order atorvastatin for sale buy lipitor 10mg generic buy atorvastatin 20mg
1958年Puke实验室将此连续传代细胞进行重新克隆后,应该是Puck实验室吧?有些疑惑?